식약처, 국내 유통 의약품 품질연구 결과 발표
식품의약품안전처는 국내에서 유통되는 의약품이 허가받은 대로 제조돼 유통·판매되고 있는지 확인하기 위해 국내 유통 의약품의 품질연구를 실시한 결과, 연구 대상 모두 허가 사항대로 품질이 유지되고 있다고 9일 밝혔다.
식약처에 따르면 이번 연구는 국내 유통 의약품의 품질이 허가 당시 기준대로 잘 유지되고 있는지 점검하고, 품질경쟁력 강화방안을 모색하기 위해 실시됐다.
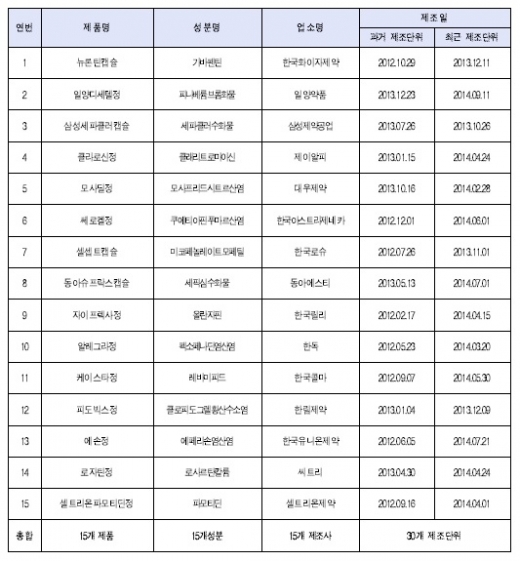
연구 대상은 국내에서 유통되는 의약품 중 품질이 변경될 가능성이 상대적으로 높은 15개 품목을 선정하고, 품목별로 제조단위가 다른 2개씩을 수거한 총 30개 제품이다. 제조단위란 제약사가 제조 관리하는 단위로, 소비자는 제품에 표시된 제조번호를 통해 동일 제조단위를 확인할 수 있다.
연구는 제품 별로 함량시험(제품에 정확한 양의 약효 성분이 들어 있는지 측정)·용출시험(약에서 약효 성분이 정해진 시간내에 잘 녹아나오는지 측정) 등 품질기준에 대한 적합 여부를 확인하기 위한 ‘품질관리시험’을 실시했다.
또 제조단위 간 품질유지(제조일자에 따른 품질 변화정도) 여부를 확인하기 위해 ‘의약품동등성시험(일반적으로 원개발과 제네릭의약품간의 동등성을 비교하는데 사용되는 시험)’을 추가로 진행했다.
전 세계적으로 제조단위 간 품질유지를 동등성 판정기준에 따라 평가하지는 않지만, 품질경쟁력 강화방안을 모색하고자 엄격한 기준으로 평가를 시도했다는 게 식약처 측 설명이다.
용출시험·함량시험 등 품질에 대한 적합 여부를 확인한 결과, 연구대상 모두 제조 당시 허가받은 품질 기준을 만족했으며, 유통기간 경과(최대 34개월·평균 17개월)에 따른 품질 변화도 없었다.
또 제품의 제조단위간 품질유지 여부를 확인한 결과 모든 제품은 제조단위 간 품질이 적절히 유지되고 있었으며, 일부 제품에서 약간 차이는 있었으나 안전성·유효성에는 문제없는 수준이었다.
식약처 관계자는 “이번에 조사된 연구 내용에 대해 지난 2일 의사·약사·소비자단체 등으로 구성된 중앙약사심의위원회의 자문을 받았다”며 “15개 품목 모두 허가받은 대로 적정하게 관리되고 있다고 결론내렸다”고 밝혔다.
이 관계자는 이어 “국내 관련 전문가 등으로 ‘글로벌 의약품 품질 경쟁력 강화 기획추진단’을 구성, 정책과제를 발굴·추진하는 등 의약품 품질 향상을 위해 지속적으로 노력하겠다”고 덧붙였다.











!['바람의나라 클래식', 원작 재현만으로 장기 흥행 가능할까 [딥인더게임]](https://img.etoday.co.kr/crop/320/200/2102375.jpg)