미국ㆍ캐나다 이어 국내기술 바이오신약 중 최초 승인..판매 로열티 수입 기대
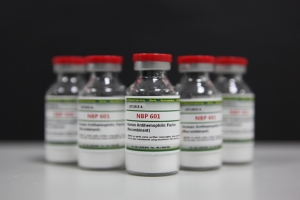
SK케미칼은 호주 제약사 CSL베링에 기술수출한 혈우병치료제 ‘앱스틸라'가 유럽의약국(EMA, European Medicines Agency)으로부터 최종 시판 허가를 받았다고 10일 밝혔다. 국내 기술로 개발한 바이오신약 중 처음으로 유럽 관문을 통과했다.
앱스틸라는 지난해 5월 미국 식품의약국(FDA)의 시판 허가를 받았고 12월 캐나다에서도 시판 허가를 획득했다. 현재 호주, 스위스 등에서 허가 심사 단계에 있다.
앱스틸라는 SK케미칼이 자체 기술로 개발해 2009년 호주CSL에 기술 이전한 바이오신약이다. CSL이 생산공정개발, 글로벌 임상 및 허가 신청을 진행해왔다.
앱스틸라는 기존치료제보다 생산성은 높이고 약효지속시간을 늘린 차세대 혈우병치료제로 평가받는다.
SK케미칼 관계자는 “앱스틸라는 유전자 결합 구조의 변화 덕분에 임상 결과 기존 제품에 비해 제8인자의 체내 유지 시간을 1.5~2배 가량 증가시켜 체내 반감기를 증가시켰다”고 설명했다. 앱스틸라는 임상1/2상에서 박스액타의 ‘애드베이트’보다 반감기가 1.4배 증가한 것으로 확인됐다.
앱스틸라는 임상시험을 통해 주 2회 투여가 효과있다는 점을 인정받았다. 또 기존에 치료를 받던 환자들에게서 중화항체반응이 한 건도 보고되지 않았다고 SK케미칼 측은 설명했다. 중화항체반응은 약물 효과를 저해하는 항체가 형성되는 반응으로 A형 혈우병 치료제의 가장 심각한 부작용으로 지목된다.
CSL베링은 앱스틸라가 전세계 A형 혈우병치료제 시장에서 혁신적인 치료제로서 자리매김할 것으로 예상하고 있다. SK케미칼은 글로벌 판매에 따른 로열티와 판매 마일스톤을 기대하고 있다. SK케미칼은 앱스틸라 매출액의 약 5%를 받는 것으로 알려졌다.
CSL의 R&D 총괄 관리자인 앤드류 커버슨 박사는 “앱스틸라의 유럽 시판 허가를 통해 환자들이 보다 나은 삶을 위한 치료 대안을 얻게 됐다”고 전했다.
박만훈 SK케미칼 사장은 “연구개발의 오랜 투자가 또 하나의 결실로 이뤄지고 있다”며 “향후 백신∙혈액제 등 바이오 사업에서 지속적인 성과를 내 글로벌 기업으로서의 역량을 갖춰나갈 것”이라고 말했다.










![요즘 가요계선 '역주행'이 대세?…윤수일 '아파트'→키오프 '이글루'까지 [이슈크래커]](https://img.etoday.co.kr/crop/320/200/2099221.jpg)