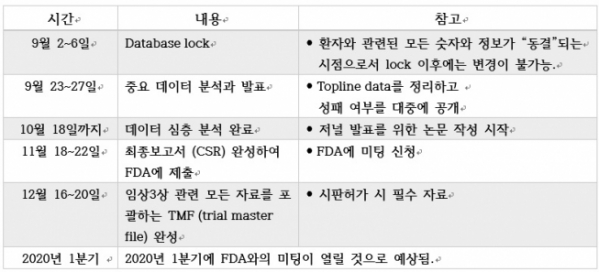
헬릭스미스는 VM202-DPN 임상3상 자체 결과 “현재의 데이터만으로는 혼용 피험자에 대한 정확한 확인이 불가능해 별도 조사가 필요한 상황“이라며 “11월에 제출할 최종보고서와 12월로 예상되는 임상3상 종료 미팅에서 이를 상세하게 FDA측에 보고할 예정”이라고 23일 공시했다.
회사 측은 안전성에 대한 부분에선 “임상 피험자 전원에 걸쳐 이상반응 빈도가 매우 낮게 나왔고, 약물과 관련됐다고 판단한 중대한 이상반응(SAE)은 없었다”며 “또한 주사부위 반응도 1건을 제외하고는 모두 경미한 사례였다는 점에서 위약과 엔젠시스군 간의 피험약 혼용 가능성과 상관없이 엔젠시스의 안전성이 다시 한번 입증됐다”고 설명했다.
이어 “피험약 혼용 가능성으로 플라시보와 엔젠시스의 효과가 크게 왜곡돼 명확한 결론 도출이 불가능하게 됐다”며 “예를 들어 모든 피험자를 분석 대상으로 하는 ITT (Intent-to-treat) 군에서 1차 평가지표인 3개월 통증감소 효과의 차이는 위약과 대비 통계적으로 유의미하지 않게 나왔지만, 오류 가능성이 높은 환자들을 제외한 분석에서는 통계적으로 유의미한 통증 효과가 있었기 때문”이라고 했다.










![[찐코노미] 테슬라, 진정한 성장 시작되나…국내 자율주행 기술 수준은?](https://img.etoday.co.kr/crop/320/200/2098264.jpg)