신종 코로나바이러스 감염증(코로나19) 치료제와 백신 관련 임상시험 12건이 국내에서 진행 중이며, 5건은 심사 중인 것으로 나타났다.
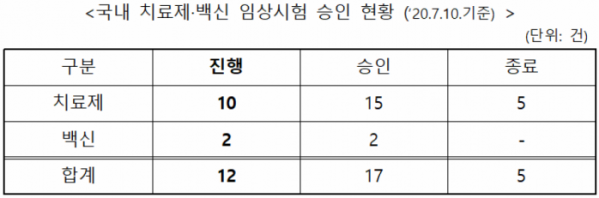
식품의약품안전처는 현재 국내에서 코로나19 관련 진행 중인 임상시험은 총 12건이라고 10일 밝혔다. 세부적으로는 치료제 10건, 백신 2건이다.
지난달 26일 이후 2건의 임상시험이 추가로 승인되고 5건은 종료됐다. 승인된 임상시험은 약물 재창출을 통해 이미 허가된 카모스타트 성분 의약품을 이용해 개발 중인 크리스탈지노믹스의 ‘CG-CAM20’와 대웅제약의 ‘DWJ1248정이다.
카모스타트는 만성 췌장염 및 역류성 식도염 치료를 위해 사용하는 의약품이다. 세포 단계 시험에서 코로나19 바이러스의 활성을 억제했고, 바이러스가 감염된 마우스(쥐)에서 생존율 개선 효과를 보였다. 현재 미국과 영국, 독일 등 5개국에서 카모스타트를 이용한 임상시험이 진행되고 있다.
종료된 임상시험은 렘데시비르 3건 및 옥시크로린정·칼레트라정, 할록신정 각 1건이다. 렘데시비르는 계획대로 임상시험이 완료됐으며, 옥시크로린정(히드록시클로르퀸)·칼레트라정 비교임상 및 할록신정(히드록시클로르퀸) 임상은 히드록시클로로퀸의 코로나19 관련 치료적 유익성이 인정되지 않는다는 해외 연구 결과 등에 따라 종료됐다.
백신은 2건 모두 초기 단계(1상~2상)로, 국내 개발 백신으로는 제넥신의 ‘GX-19’가 있다.
현재 임상시험계획을 심사 중인 코로나19 치료제·백신은 5개이며, 신청을 위해 사전상담이 진행 중인 의약품은 33개다. 심사 중인 5개 제품은 모두 국내 개발 치료제로, 신약 항체치료제가 1개, 약물재창출 치료제가 4개이다.
사전상담은 혈장분획치료제 등 치료제 23개 제품, 백신 10개 제품이 진행 중이다. 이 가운데 국내개발은 27개이며, 혈장분획치료제 등 일부 제품은 조만간 임상시험 승인을 신청할 예정이다.
앞서 영국과 세계보건기구(WHO)는 칼레트라의 임상시험 자료를 분석한 결과, 코로나19 입원 환자의 사망률 개선에 대한 효과 부족으로 임상시험 중단을 각각 발표했다. 국내에서는 칼레트라와 히드록시클로르퀸을 비교하는 1건의 연구자 임상시험이 승인됐으나, 히드록시클로르퀸의 치료적 유익성이 인정되지 않는 이유로 종료됐다.
양진영 식약처 차장은 “의약품 규제기관 국제연합, 세계보건기구와 함께 코로나19 관련 연구현황, 임상시험 정보 및 치료제·백신 규제 현황에 대해 지속적으로 협력하고 있다”며 “지난 6월에는 유럽 의약품청과 코로나19 진단·예방 치료의약품에 대한 상호정보교환 시 비밀을 유지하는 임시약정을 체결하는 등 국제적인 공조를 확대해나가고 있다”고 말했다.











![요즘 가요계선 '역주행'이 대세?…윤수일 '아파트'→키오프 '이글루'까지 [이슈크래커]](https://img.etoday.co.kr/crop/320/200/2099221.jpg)