FDA, 10월 백신 관련 논의 자문단 구성중…러시아·중국 등도 올해 말 목표로 개발 박차
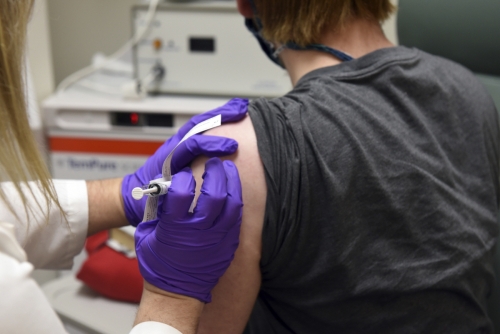
화이자와 바이오엔테크는 이날 성명을 내고 1상 임상시험 추가 분석 결과를 발표했다. 성명에 따르면 두 업체가 개발한 백신 후보물질 BNT162b2를 투여받은 실험 참가자 중 20% 미만에게서 경증~중증도 열감이 나타났다. 이전에 효과를 본 BNT162b1보다 BNT162b2가 더 적은 부작용을 보였다는 내용도 포함됐다. 화이자와 바이오엔테크는 미국과 독일에서 진행된 1상 시험 결과를 계속해서 추가 분석할 예정이다.
지난달 말 화이자와 바이오엔테크는 백신 개발 마지막 단계인 3상 돌입을 발표하며 10월에 보건당국의 승인을 받겠다는 목표를 제시했다. 만약 화이자의 목표가 달성된다면 이는 세계에서 가장 빨리 보급되는 코로나19 백신 중 하나가 된다. 몇몇 전문가들은 백신이 11월 미국 대통령선거를 앞둔 시점에 승인될 것으로 전망한다.
미국 정부는 지난달 22일 화이자와 바이오엔테크에 20억 달러(약 2조3726억 원)를 지원하는 대신 3차 임상시험에서 백신의 안전성과 효과가 입증되면 1억 회분을 인도받기로 했다. 미 식품의약국(FDA)은 오는 10월 22일 코로나19 백신에 대해 논의할 자문단을 구성하고 있는 것으로 전해졌다. 하지만 어떤 회사의 백신을 대상으로 한 논의인지는 알려지지 않았다.
올해 말 백신 보급을 목표로 하는 기업은 화이자뿐만이 아니다. 러시아의 가말레야 연구소가 개발한 코로나19 백신 ‘스푸트니크V’는 10월 중에 실제 접종을 시작할 방침이다. 하지만 아직 3상 시험이 진행 중이라 안전성이 입증되지 않았다는 비판이 일고 있다.
중국의 국영 제약회사인 시노팜은 아랍에미리트(UAE)와 바레인에서 각각 3상 시험을 진행하고 있다. 시노팜은 연말 전에 백신이 출시될 것이며 가격은 2회 복용에 1000위안(약 17만1970원)으로 책정될 것이라고 밝혔다. 중국 시노백은 브라질과 인도네시아에서 임상 3상을 진행하고 있으며 백신이 내년 초 중국 당국의 승인을 받을 것으로 예상한다.










![[정치대학] 尹대통령, 최저 지지율로 임기 반환점…결정적 패착은?](https://img.etoday.co.kr/crop/320/200/2101165.jpg)