이재우 GC녹십자 개발 본부장 "혈장 공급, 치료제 개발 성패 좌우"
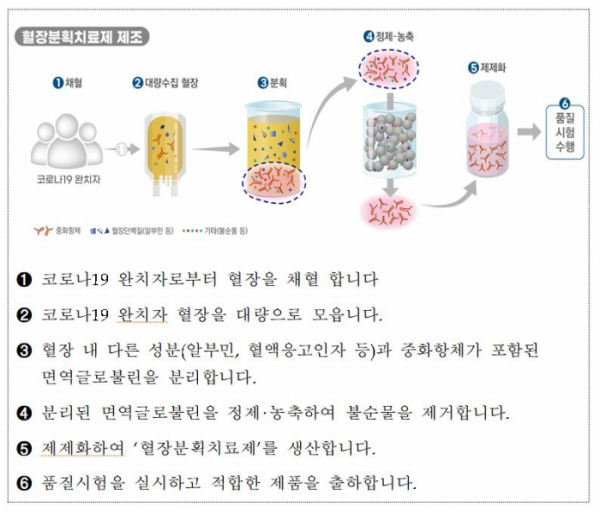
GC녹십자가 코로나19 혈장치료제 임상 2상 시험에서 환자를 대상으로 첫 투여를 시작한다.
이재우 GC녹십자 개발본부장은 9일 온라인으로 열린 ‘2020 글로벌 바이오 콘퍼러스(GBC)’에서 ‘코로나19 특수혈장치료제 개발 현황’이란 주제로 한 강의에서 “코로나19 혈장치료제 후보물질 ‘GC5131’에 대한 임상 2상 시험을 진행 중이고, 6개 임상 참여 병원에서 진행 예정인 첫 환자 투여는 다음주 시작한다”라고 말했다.
앞서 식약처는 지난달 20일 녹십자에서 코로나19 완치자의 혈장을 이용해 개발 중인 ‘고면역글로불린(Hyper-immune Globulin)’ 성분의 치료제 물질 ‘GC5131’의 2상 임상시험을 승인했다. 이에 녹십자는 6개 병원(서울아산병원ㆍ삼성서울병원ㆍ중앙대병원ㆍ고대안산병원ㆍ충남대병원ㆍ연대 세브란스병원)에서 환자 60명을 대상으로 혈장 치료제의 안전성과 유효성 확인에 나선다. 영상학적 진단으로 확인된 폐렴 환자와 고령 및 기저질환이 있는 고위험군 환자가 대상이다.
이 본부장은 “이번 임상 마지막 환자 투여는 올해 말께로 예상한다”라며 “3상에 들어가면 치료제 원료 물질인 ‘혈장’이 더 많이 필요한데 혈장을 얼마나 확보하느냐에 따라 치료제 개발의 성패가 달렸다”라고 강조했다.
그러면서 혈장 공여를 위한 국가적 캠페인의 필요성을 언급했다. 이 본부장은 “면역글로불린은 예측이 가능하고, 부작용이 적고, 연구 개발에 오랜 시간 걸리는 백신과 달리 당장 사용할 수 있는 유일한 치료 대안”이라며 “치료제 개발의 성패를 가르는 빠른 혈장 공급을 위해선 완치자 헌혈에 대한 국가적 캠페인이 절실하다”라고 말했다. 이어 “만약 혈장이 부족하면 현재 혈장을 돈 주고 공급받는 시스템이 가능한 나라는 미국이 유일한 만큼 미국에서 수입하는 방법 등 여러 방안을 고민해야 할 것”이라고 말했다.
한편 GC녹십자 외에 미국과 유럽에서 공동체를 구성해 혈장치료제를 개발 중이다. 이 본부장은 “GC녹십자도 이 공동체에 참가하고 있지만, 공동개발이 아닌 공동 관심사에 대한 정보를 공유하는 정도”라며 “해당 공동체는 1, 2상을 건너뛰고 현재 3상 임상을 진행 중”이라고 말했다.










![[찐코노미] 테슬라, 진정한 성장 시작되나…국내 자율주행 기술 수준은?](https://img.etoday.co.kr/crop/320/200/2098264.jpg)