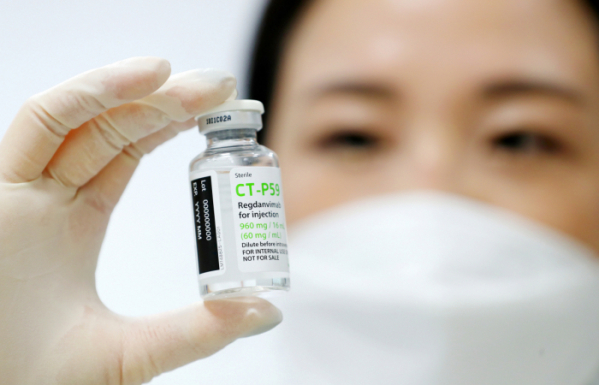
식품의약품안전처가 셀트리온의 코로나19 항체치료제의 2월 초 허가를 전망했다.
김강립 식약처장은 25일 열린 2021년도 대통령 업무 보고(화상회의)에서 “2월 초쯤 국내 최초 치료제에 대한 결정이 나올 것으로 예상한다”라며 현재 심사 중인 셀트리온의 코로나19 항체치료제 ‘렉키로나주’(성분명 레그단비맙·CT-P59)의 허가를 예상했다.
앞서 식약처는 ‘렉키로나주’ 2상 임상시험 자료에 대한 검증 자문단의 자문을 받았고, 27일에는 중앙약사심위원회 자문을 받는다. 검증 자문단 회의에서는 렉키로나주의 효과성을 인정했지만 추가 검증이 필요하다고 판단했고, 결론적으로 식약처에 조건부 허가를 권고했다. 중앙약사심의위원회 자문 결과는 당일 공개될 예정이다.
이날 식약처는 올해 코로나19 백신 5건, 치료제 3건 이상을 조기에 도입할 수 있도록 개발을 적극 지원하겠다고 밝혔다. 우리나라는 현재 모더나(2000만 명분), 화이자ㆍ아스트라제네카(각각 1000만 명분), 얀센(600만 명분) 백신을 확보했고, 노바백스와 2000만 명분의 백신 선구매 계약도 추진 중이다.
이에 김 처장은 “치료제의 경우 렉키로나주 외에 현재 국내에서 임상시험이 진행되고 있거나 기획단계에 있는 제품 중 가급적 많은 제품이 현장에서 사용될 수 있도록 하겠다. 백신의 경우 5건 가운데 4건은 이미 도입 계약을 완료했고, 1건은 추가적으로 계약을 진행 중”이라고 말했다.
이날 식약처는 아스트라제네카에 이어 이날 화이자가 개발한 코로나19 백신 ‘코미나티주’의 허가 심사에 착수했다. 먼저 허가심사에 들어간 아스트라제네카 코로나19 백신에 대한 검증 자문단 회의는 31일 열리고, 결과는 2월 1일 공개 예정이다.










![[찐코노미] 테슬라, 진정한 성장 시작되나…국내 자율주행 기술 수준은?](https://img.etoday.co.kr/crop/320/200/2098264.jpg)