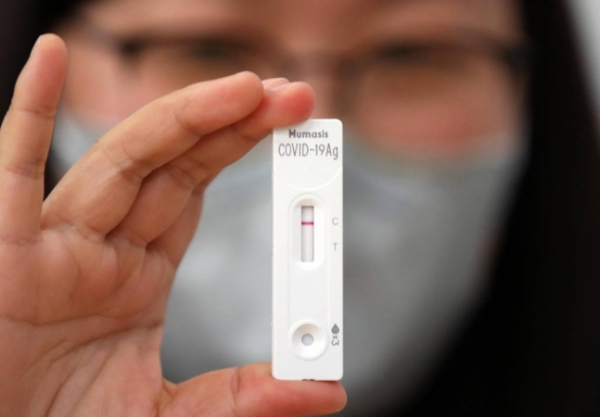
SD바이오센서와 휴마시스의 자가검사키트 2개 제품이 정식 품목허가를 받았다.
식품의약품안전처는 지난 4월 조건부 허가한 항원방식 자가검사키트 2개 제품(에스디바이오센서, 휴마시스)에 대해 추가 제출된 임상적 성능시험 자료를 검토한 결과, 모두 민감도 90% 이상, 특이고 99% 이상으로 허가기준을 충족해 각각 품목허가했다고 13일 밝혔다.
앞서 식약처는 지난달 13일 래피젠의 항원방식 자가검사키트를 정식 품목허가해 이로써 모두 3개의 자가검사키트 제품이 허가돼 국내에 판매, 유통할 수 있게 됐다.
식약처는 “한시적으로 운영돼 온 코로나19 자가검사키트의 조건부 허가는 종료됐고, 향후 코로나19 진단시약의 신속한 인·허가와 개발지원은 계속할 예정”이라고 말했다.
현재까지 코로나19 진단시약은 총 58개 제품이 허가됐고 이 가운데 유전자 진단시약(PCR)은 27개, 항원 진단시약은 17개(자가검사키트 3개 포함), 항체 진단시약은 14개 제품이 있다. 코로나19 항체 진단시약은 코로나19 감염 이후에 항체의 생성 여부를 확인하는 데 도움을 줄 수 있는 제품으로, 현재 전문가용으로만 총 14개 제품이 허가됐다.
식약처는 코로나19 항체 진단시약의 ‘자가검사키트’ 허가 필요성을 검토한 결과 △현재까지의 항체 진단시약이 면역력을 가늠하는 중화항체를 정확히 구별해 진단하지 못하는 점 △항체 진단시약에 대한 일반 소비자들의 사용목적·방법에 대한 오남용 우려 △국내 방역 여건 등을 종합적으로 고려해 전문가용으로만 허가하기로 결정했다.
식약처는 “현재 항체 진단시약은 코로나19 감염 진단에 사용할 수 없고 코로나19에 대한 개인의 면역과 감염 예방 능력을 확인하는 중화항체나 백신 접종 후 항체 생성 여부를 확인할 수 없다”라고 설명했다.











![1300원부터 5000원까지…아메리카노 얼마가 적당할까 [데이터클립]](https://img.etoday.co.kr/crop/320/200/2098627.jpg)