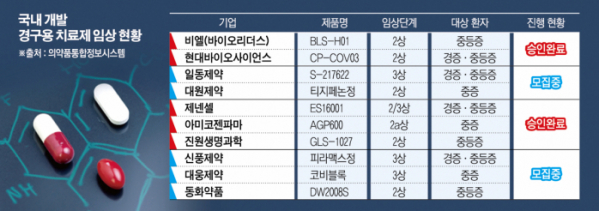
27일 이투데이 취재 결과 국내 제약·바이오기업 10여 곳이 코로나19 경구용 치료제 임상 2상 또는 3상 단계에 진입해 있다. 최근 비엘(바이오리더스)이 새롭게 2상 임상시험계획(IND) 승인을 받는 등 후발주자도 꾸준히 등장하고 있다.
현재 국내에서 사용되는 경구용 치료제는 화이자의 '팍스로비드'와 머크의 '라게브리오' 2종이다. 전량 수입에 의존하고 있어 언제든지 공급 리스크가 발생할 우려가 있다.
임상 2상을 진행 중인 국내 바이오기업들은 개발 완주 의지를 강조하고 있다. 기존 경구용 치료제와 차별화된 원료나 기전을 무기로 충분히 '팔리는 약'이 될 수 있을 것이란 믿음에서다.
현대바이오의 'CP-COV03' 임상 2상은 국가임상시험지원재단의 지원 대상에 선정됐다. 임상 2상 단계에 있는 코로나19 치료제가 재단의 지원을 받는 첫 사례다. 경증·중등증 환자 300명을 대상으로 진행되며, 이달 초 임상연구심사위원회(IRB) 승인을 받아 투약을 앞두고 있다. 개발에 성공하면 동국제약에서 완제품을 제조할 예정이다.
CP-COV03은 바이러스가 숙주인 세포에 침입하면 세포가 바이러스를 제거하는 기전이다. 복용 시 몸속의 바이러스 농도가 빠르게 감소해 증상 완화를 빠르게 체감할 수 있는 장점이 있다고 회사 측은 설명했다.
현대바이오 관계자는 "CP-COV03은 약물전달체 기술을 활용해 생체효용률을 획기적으로 끌어올렸다"면서 "팍스로비드와 달리 병용 금기 약물이 거의 없고, 라게브리오보다 효과가 뛰어날 것으로 예상한다"고 말했다.
지난달 22일 코로나19 중등증 환자를 대상으로 'BLS-H01' 임상 2상을 승인받은 비엘은 제뉴원사이언스에서 본격적인 임상용 의약품 생산에 돌입했다. 항바이러스 표준치료제와 병용을 통해 환자 모집에 속도를 낼 것으로 회사 측은 기대하고 있다.
BLS-H01은 변이 바이러스 유형과 관계없이 작용하는 면역조절 기반 치료제다. 핵심물질 폴리감마글루탐산(감마-PGA)이 선천성 면역의 주축을 이루는 자연살해세포(NK-Cell)를 활성화하고, 면역세포로부터 면역매개물질 분비를 촉진해 항바이러스 기능을 발휘하는 기전을 갖고 있다.
회사 관계자는 "현재 임상연구심사위원회(IRB) 승인을 진행하고 있어 2~3개월 내 본격적인 투약이 예상된다"며 "코로나19가 중증으로 진행하는 것을 막을 수 있어 기존 치료제 대비 경쟁력이 있다"고 강조했다.
천연물 기반 경구용 치료제 'ES16001'를 개발 중인 제넨셀은 25일 아랍에미리트(UAE) 오르디파마와 판권 이전 관련 업무협약(MOU)를 체결했다. 제넨셀은 앞서 원료 재배단지를 확보하는 등 상용화에 대한 의지를 드러냈다.
ES16001은 코로나19 원인 바이러스(SARS-CoV2)의 바이러스-숙주세포 수용체 결합 영역(RBD)과 숙주세포의 ACE2 수용체 결합을 억제하는 기전이다. 국내에서는 임상 2/3상 투약을 앞두고 있다.

국내에서 개발하는 코로나19 치료제 다수는 환자 모집과 투약에 많은 시간이 소요돼 임상 진척에 차질을 빚고 있다. 2020년 임상 승인을 받은 대웅제약과 동화약품은 아직 환자 모집 단계이며, 지난해 임상 승인을 받은 진원생명과학, 아미코젠파마, 제넨셀, 대원제약은 아직 본격적인 임상에 들어가지 못했다.
대웅제약은 2002년 12월 코로나19 중증 환자를 대상으로 '코비블록'의 임상 3상에 진입했다. 그러나 약 1년 반 동안 아직 투약이 한 건도 이뤄지지 않은 것으로 확인됐다. 목표 대상자는 1022명이다.
대웅제약 관계자는 "백신 접종과 오미크론 변이의 확산으로 중증 환자가 줄어들면서 환자 모집에 어려움을 겪고 있다"면서 "효능에 대한 자신감이 있으므로 개발은 완주할 것"이라고 말했다.
국내에서 진행 중인 경구용 치료제 임상 가운데 현시점에서 가장 속도가 빠른 후보물질은 일동제약이 일본 시오노기와 공동 개발하는 'S-217622'이다. 시오노기는 24일 유럽 임상미생물학·감염질환 학회(ECCMID)에서 임상 2b상 결과를 발표했다.
시오노기가 공개한 내용에 따르면 임상 2b상에서는 경증·중등증 감염자 428명(일본 419명·한국 9명)을 대상으로 1일 1회 5일간 경구 투여했을 때 4일째 바이러스 역가 양성 환자 비율이 위약군 대비 90% 감소했으며, 오미크론 변이 관련 증상을 개선하는 것을 확인했다.
시오노기는 2월 25일 일본 허가당국에 S-217622의 조건부 승인을 신청했으며, 미국국립보건원(NIH)의 지원을 받아 글로벌 임상 3상을 준비하고 있다. 일동제약은 현지 승인을 받는 대로 국내 사용을 위한 절차를 밟을 예정이다. 국내 임상은 늦어도 5월까지 마무리될 것으로 전망된다. 개발에 성공하면 기술이전을 통한 국내 생산이 가능해 안정적인 경구용 치료제 공급원이 될 가능성이 있다.










![[정치대학] 美 대선, 막판까지 초박빙…당선자별 韓 영향은?](https://img.etoday.co.kr/crop/320/200/2098110.jpg)