FDA, 허가신청서 접수..내년 상반기께 시판 승인 전망
셀트리온은 미국 식품의약품국(FDA)에 항체 바이오시밀러 ‘트룩시마(성분명 리툭시맙)’의 허가를 신청했다고 29일 밝혔다.
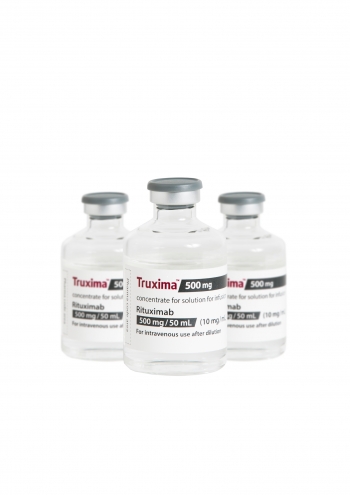
셀트리온 측은 트룩시마의 FDA 승인은 내년 상반기께 이뤄질 것으로 전망했다.
트룩시마는 세계적으로 약 8조원 이상의 매출을 기록 중인 로슈의 ‘맙테라(미국 판매명 리툭산)’의 바이오시밀러 제품이다. 맙테라의 미국 매출은 지난해 4조6400억원 규모로 세계 매출의 약 53%를 차지한다.
셀트리온은 지난 2월 리툭시맙 바이오시밀러 개발 기업 중 최초로 유럽의약품청(EMA, European Medicines Agency)으로부터 트룩시마의 판매 허가를 받았다. 현재 트룩시마는 국내를 비롯해 영국, 독일, 네덜란드, 스페인, 아일랜드 등에서 판매 중이다.
셀트리온은 이미 혈액암 적응증과 류마티스관절염 환자를 대상으로 한 트룩시마의 임상을 완료했으며, 미국혈액암학회(ASH), 미국임상종양학회(ASCO), 유럽류마티스학회(EULAR) 등 유명 학회에서 임상 결과를 발표한 바 있다.
셀트리온은 지난해 테바와 트룩시마와 허쥬마의 북미 판권 계약을 체결했으며, FDA로부터 판매 승인을 받게 되면 항암제 분야에서 강점을 지닌 테바를 통해 미국 시장에 안착한다는 계획이다.
기우성 셀트리온 대표는 “지난 해 FDA의 승인을 받고 미국 시장에 선보인 최초의 항체 바이오시밀러인 램시마에 이어 트룩시마가 FDA의 승인을 받게 되면 보다 합리적인 비용으로 고품질의 의료혜택을 미국의 환자들에게 제공할 수 있을 것으로 기대한다”고 내다봤다.
기 대표는 “허가 승인 및 출시까지 여러 절차가 남아있지만, 유럽에서와 마찬가지로 미국에서도 트룩시마가 조기에 허가를 받아 성공적으로 미국에 선보일 수 있도록 최선을 다하겠다”고 말했다.
폴 리트먼 테바 항암제 부문 부사장은 “트룩시마는 암·류마티스관절염 등 중대 질환 분야에서 바이오의약품과 화학의약품을 아우르는 테바의 독특한 의약품 포트폴리오를 보완하는 중요한 역할을 할 것으로 기대하고 있다”고 강조했다.










![요즘 가요계선 '역주행'이 대세?…윤수일 '아파트'→키오프 '이글루'까지 [이슈크래커]](https://img.etoday.co.kr/crop/320/200/2099221.jpg)