글로벌 블록버스터 의약품의 특허가 잇따라 만료되면서 바이오시밀러 시장을 뜨겁게 달구고 있다. ‘아일리아’ 바이오시밀러 시장이 열리면서 국내외 기업들의 경쟁이 치열한 가운데, 내년에는 8조 원 규모의 ‘프롤리아’ 바이오시밀러 시장이 개화한다.
14일 제약·바이오업계에 따르면 미국 다국적 제약사 암젠이 개발한 골다공증 치료제 프롤리아(성분명 데노수맙)는 2025년 2월과 11월 미국과 유럽에서 각각 특허가 만료된다. 프롤리아는 파골세포의 활성화를 촉진하는 세포막 단백질(RANKL)을 억제해 골파괴를 줄이고 골질량과 골강도를 증가시키는 약이다. 암환자의 골 전이 합병증을 예방 치료하는 ‘엑스지바’로도 허가됐다.
지난해 프롤리아·엑스지바의 글로벌 매출은 61억6000만 달러(약 8조4000억 원)를 기록했다. 이 가운데 약 70%가 미국에서 발생했다.
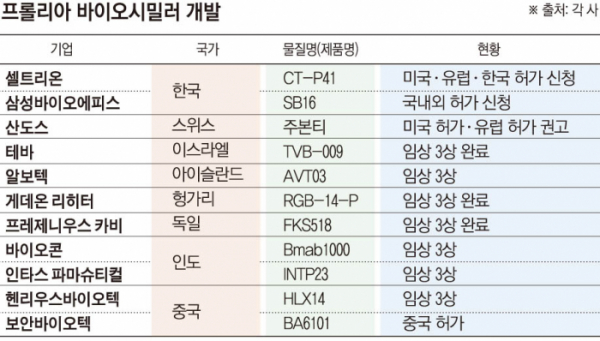
국내에서는 셀트리온과 삼성바이오에피스가 프롤리아 바이오시밀러의 글로벌 허가 절차를 밟고 있다. 휴온스랩도 개발에 나섰지만, 아직 초기 단계다.
셀트리온은 지난해 12월 미국 식품의약국(FDA)에 프롤리아 바이오시밀러 ‘CT-P41’의 품목허가를 신청했다. 골다공증, 골소실, 다발성 골수종 및 고형암 골 전이로 인한 골격계 합병증 예방, 골거대세포종 등 프롤리아·엑스지바가 미국에서 보유한 전체 적응증에 대해서다. 같은 달 한국, 올해 3월 유럽에서도 허가 신청을 완료했다.
임상 3상은 폴란드와 에스토니아 등 4개국에서 골다공증이 있는 폐경기 여성 환자 477명을 대상으로 진행돼, 오리지널 의약품 대비 동등성 및 약력학적 유사성을 확인했다. 허가 시 셀트리온은 바이오시밀러 제품 영역을 자가면역질환 치료제·항암제에서 골 질환 치료제로도 확대하게 된다.
삼성바이오에피스는 폴란드 등에서 457명을 대상으로 2021년 12월 ‘SB16’의 글로벌 임상 3상을 완료했다. 현재 국내 및 해외 허가를 추진 중으로, 국가와 신청 시점 등 세부사항은 전략 노출을 막기 위해 공개하지 않는다.
다만 첫 번째 FDA 허가 프롤리아 바이오시밀러는 올해 3월 이미 탄생했다. 산도스가 개발한 ‘주본티(Jubbonti)’와 ‘와이오스트(Wyost)’가 주인공이다. 각각 프롤리아, 엑스지바와 제형 및 투여방법이 같고, 오리지널 의약품의 모든 적응증에 대해 교체처방(Interchangeable)이 가능하다.
산도스 외에도 각국에서 프롤리아 바이오시밀러 개발에 한창이다. 임상 3상을 마쳤거나 완료에 속도를 내고 있다.
중국에서는 상하이헨리우스바이오텍과 산동보안바이오텍이 개발 중이다. 헨리우스바이오텍은 2022년 오가논과 손잡고 ‘HLX14’의 중화권을 제외한 전 세계 독점적 상업화 권리를 넘겼다. ‘BA6101’를 개발한 보안바이오텍은 중국 1호 프롤리아 바이오시밀러로 허가받아 ‘보요우베이(Boyoubei)’란 이름으로 판매하고 있다.
이스라엘의 테바는 지난해 6월 ‘TVB-009’의 임상 3상을 완료했다. 유럽에서는 알보텍(AVT03), 프레제니우스카비(FKS518), 게데온 리히터(RGB-14-P) 등이 참전했다. 인도에선 바이오콘이 ‘Bmab1000’, 인타스 파마슈티컬이 ‘INTP23’의 임상 3상을 진행 중이다.











![[컬처콕 플러스] 아일릿, 논란 딛고 다시 직진할 수 있을까?](https://img.etoday.co.kr/crop/320/200/2095915.jpg)