[ASCO 2024]TU2218 고용량과 키트루다 병용투여한 5명 환자 가운데 2명에게서 PR 관찰
티움바이오(Tiumbio)가 지난 1일(현지시간) 미국 시카고에서 열린 미국 임상종양학회(ASCO 2024)에서 TGFβ(ALK5)/VEGFR2 이중저해제 ‘TU2218’과 PD-1 면역항암제 ‘키트루다’를 병용투여한 고형암 임상1b상 중간 결과를 첫 공개했다.
티움바이오는 현재 미국내 임상기관 3곳에서 진행성 고형암 환자를 대상으로 TU2218과 키트루다를 병용투여하는 임상1b상을 진행하고 있으며, 임상에서 TU2218 3가지 용량(105, 150, 195mg)을 1일1회 경구투여해 평가하고 있다(NCT05784688). 이번 ASCO에서는 병용투여 임상에 참여한 환자 12명 가운데, 효능평가가 가능한 환자 11명의 결과를 발표했다.
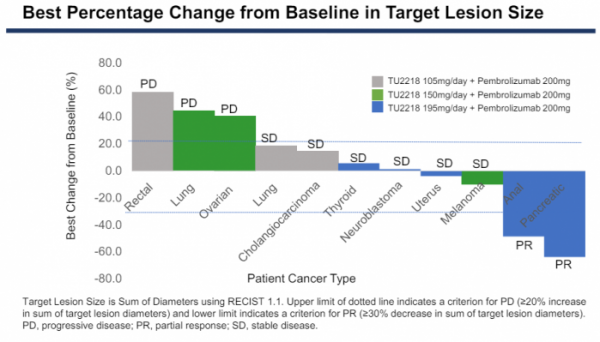
임상1b상 병용투여 코호트에 참여한 고형암 환자 11명은 TU2218 저용량(3명), 중간용량(3명), 고용량(5명)을 투여받았다. 그 결과 고용량에서 약물반응이 관찰됐으며, 병용투여를 받은 환자 5명 가운데 각각 췌장암과 항문암 환자 2명이 부분반응(PR)을 보였다. 나머지 3명의 환자는 안전반응(SD)을 보였다.
그밖에 저용량을 투여받은 폐암과 담도암 환자 2명과 중간용량 흑색종 환자 1명이 SD를 보였다. 즉 병용투여 코호트에서 효능 평가가 가능한 환자 11명 가운데 2명이 PR, 5명에게서 SD가 관찰됐으며 전체반응률(ORR)은 18%(2/11명), 질병통제율(SD)은 54%(6/11명)였다.
티움바이오는 이 결과를 바탕으로 임상2상 권장용량(RP2D)을 TU2218 195mg으로 정해 평가하고 있다. 앞서 티움바이오는 TU2218 용량증량 단독투여 임상1상에서는 19명의 환자를 대상으로 약물을 평가했으며, 5명의 환자가 SD를 보였다.
김훈택 티움바이오 대표는 “키트루다를 무상으로 공급하며 임상시험을 협력하고 있는 미국 머크(MSD)는 말기 암 환자를 대상으로 한 이번 임상에서 주목할 만한 결과를 보였다고 평가했다”며 “임상1b상을 잘 마무리하고 올해 하반기에 탑라인 결과를 발표함과 동시에 두경부암, 담도암, 대장암 등 암종 대상의 임상2a상에 빠르게 진입해 치료옵션이 부족한 환자들에게 혁신적인 신약을 개발할 것”이라고 말했다.











![[컬처콕 플러스] '아파트' 대박난 로제, 제니·로사와 다른 점은?](https://img.etoday.co.kr/crop/320/200/2099568.jpg)