대웅제약 나보타 국산 첫 진출…국내 시장 포화에 국내 기업들 해외로 눈길
대웅제약의 ‘나보타’가 마침내 미국 시장에 입성하면서 ‘K-보톡스’의 영향력이 더욱 커질 전망이다. 글로벌 보툴리눔 톡신 시장을 둘러싼 국내 기업들의 경쟁도 한층 치열해지고 있다.
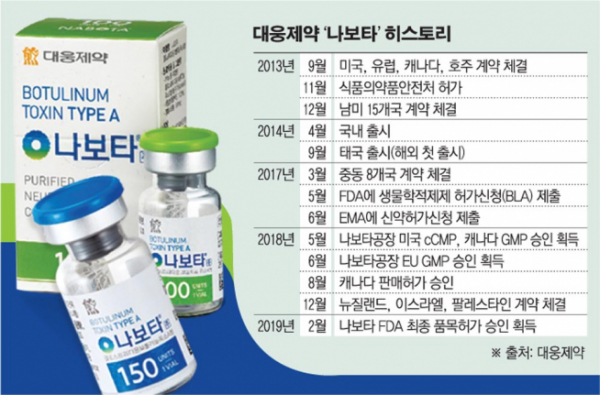
◇대웅제약 나보타 미국 허가 획득=7일 업계에 따르면 대웅제약은 1일(현지 시간) 미국 식품의약국(FDA)으로부터 나보타(미국 제품명 주보)의 최종 품목허가 승인을 받았다. 국산 보툴리눔 톡신이 미국 시장에 진출하는 것은 나보타가 처음이다.
전 세계 보툴리눔 톡신 시장은 약 4조2000억 원 규모로 알려져 있다. 미국은 이 중 2조 원 이상을 차지하는 세계 최대 시장으로, 매년 9% 이상 성장하고 있다.
나보타는 엘러간의 ‘보톡스’ 이후 미국에 처음 출시되는 900Kda 톡신으로, 임상 3상에서 보톡스와 직접 비교해 유효성과 안전성을 확인했다. 즉, 보톡스와 동일한 분자구조를 가진 제품이란 점에서 경쟁력을 갖췄다. 그간 보톡스의 후발주자들은 분자량 차이로 투여 시 단위 계산에 어려움을 겪으며 20%대 점유율에 그쳤다. 나보타와 같은 900Kda 톡신 제품으로 미국 허가를 준비 중인 메디톡스와 휴젤의 진출 시점은 일러도 2022년으로 예정돼 시간적 격차가 크다.
대웅제약은 현지 파트너사 에볼루스와 손잡고 오는 4월께 나보타를 미국 시장에 출시할 계획이다. 보톡스가 지난해 미국에서만 9억700만 달러(약 1조200억 원)의 매출을 올린 만큼, 나보타의 매출 잠재력은 매우 높은 것으로 평가받는다. 골드만삭스 보고서는 나보타가 출시 4년 후 미국 보툴리눔 톡신 미용 시장에서 25%까지 성장할 것으로 내다봤다.
◇반격 나선 ‘라이벌’ 메디톡스=국내 최초로 보툴리눔 톡신을 개발한 메디톡스는 나보타의 FDA 허가를 목전에 둔 지난달 31일 미국 국제무역위원회(ITC)에 대웅제약과 에볼루스를 제소했다. 메디톡스 전(前) 직원이 보툴리눔 균주와 보툴리눔 톡신 제제의 전체 제조공정 기술문서를 절취해 대웅제약에 제공했다는 내용이다. 미국 ITC는 해외에서 부정한 방법으로 개발한 제품이 미국에 수입돼 자국 산업에 피해를 주는 것을 조사하고, 실질적인 수입 제한 조치를 취하는 기관이다.
메디톡스는 대웅제약이 나보타의 개발 과정에 대한 의혹을 공개 토론 등을 통해 규명해야 한다고 주장하고 있다. 이와 관련 대웅제약은 “나보타의 미국 진출을 방해하기 위한 전형적인 시장진입 방어전략일 뿐”이라고 일축했다.
금융투자업계는 메디톡스의 이번 제소가 나보타의 판매에 큰 영향을 미치지 않을 것으로 내다보고 있다. 구완성 NH투자증권 연구원은 “ITC 제소는 수입금지 결정까지 통상 16개월이 넘게 걸린다”며 “수입금지 결론이 나더라도 항소할 수 있으므로 삼성전자와 애플 사례를 보더라도 4년 이상 걸릴 가능성이 높다”고 설명했다.
오히려 중요한 변수는 이르면 올해 연말에 나올 국내 소송 결과가 될 것으로 관측된다. 메디톡스와 대웅제약은 2012년부터 보툴리눔 톡신 균주 출처를 둘러싸고 진실공방을 벌이고 있다.
◇국내 시장 포화…살길은 해외=국내 보툴리눔 톡신 시장은 약 1000억 원 규모로 추산되는데, 이미 업체 간 출혈 경쟁이 심각하다. 국산 제품들은 미국을 비롯해 유럽과 중국 등 시장 확대에 힘쓰고 있다.
메디톡스는 엘러간과 함께 ‘이노톡스’의 미국 시장 진출을 추진하는 한편 중국 시장 공략에 속도를 내고 있다. 5월로 예정된 국가식품의약품감독관리총국(CFDA)으로부터 제품 판매허가를 받으면, 국내 업체 중 가장 먼저 중국 시장에 정식 진출하게 된다.
휴젤은 상반기 대만에 ‘보툴렉스’를 내놓는다. 대만 허가를 발판으로 내년에는 중국 허가를 획득해 중화권에서 세력을 넓힐 예정이다. 미국 진출을 위해서는 지난해 9월 휴젤아메리카를 설립했다.
대웅제약은 미국에 이어 나보타의 유럽의약품청(EMA) 허가를 기다리고 있다. 상반기 내 판매 승인 여부가 가시화될 것으로 보인다.











![[컬처콕 플러스] '아파트' 대박난 로제, 제니·로사와 다른 점은?](https://img.etoday.co.kr/crop/320/200/2099568.jpg)