휴젤·메디톡스 美FDA 허가 신청…대웅제약, 올해 中서 승인 기대
‘보툴렉스’ 1분기 허가 예상…‘나보타’ 심사 “순항 중”
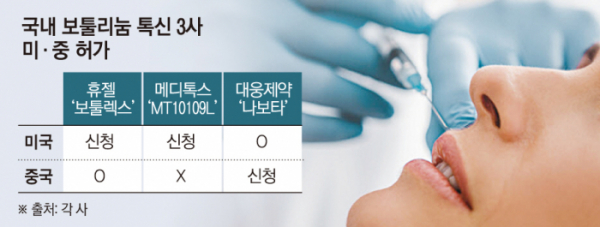
국산 보툴리눔 톡신 기업들이 미국과 중국 시장 공략에 적극적으로 나섰다. 미국과 중국은 단일 국가 기준 선두를 다투는 대규모 미용 의료시장을 형성하고 있다. 따라서 이들 국가 진출에 성공한 국내 기업들은 매출 상승의 기회를 얻게 될 전망이다.
7일 제약·바이오업계에 따르면 올해 휴젤, 메디톡스는 미국에서, 대웅제약은 중국에서 제품 허가를 추진한다.
미국 포춘(Fortune) 발표에 의하면 미국 보툴리눔 톡신 시장 규모는 2022년 기준 45억8000만 달러(약 5조9182억 원)이다. 중국 시장 규모는 65억 위안(약 1조1807억 원)으로 추정된다. 국내 시장은 2000억 원대로 평가된다.
현재 국내 보툴리눔 톡신 업계에서 유일하게 미국 식품의약국(FDA)의 허가를 받은 제품은 대웅제약의 '나보타'다. 중국 국가약품감독관리국(NMPA) 허가 제품은 휴젤의 '보툴렉스' 하나다.
휴젤은 중국에 이어 미국 진출에 공을 들이고 있다. 지난해 8월 세 번째 허가 신청서를 제출했고, 올해 1분기 중 ‘보툴렉스’에 대한 FDA 허가 심사 결과를 받을 것으로 예상된다. 앞서 2021년 3월과 2022년 10월에 허가를 신청했지만, 매번 보완요구서한(CRL)을 받으면서 절차가 미뤄졌다.
휴젤이 미국 허가까지 얻으면 미국, 중국, 유럽 등 세계 3대 보툴리눔 톡신 시장에 모두 진출한 첫 한국 기업이 된다. 휴젤 관계자는 “특이 사항이 없다면 올해 1분기 중으로 허가가 나올 것으로 예상한다”라며 “지난해 말까지 53개국에서 허가를 획득했고, 최근 유럽 지역을 중심으로 허가국이 추가되고 있다”라고 자시했다.
메디톡스 역시 미국 진출에 도전한다. 지난해 12월 FDA에 비동물성 액상형 보툴리눔 톡신 제제 'MT10109L'의 허가를 신청했다. 메디톡스는 지난해 초부터 FDA 실사에 대비해 충북 오송의 2공장에 대한 사전 점검을 진행했다. 또 이달 초엔 지분율 100%의 미국 현지 법인 ‘루반타스’를 설립하며 미국 시장 진출에 대비하고 있다. 메디톡스가 목표로 하는 현지 출시 시점은 2025년이다.
메디톡스는 계열사 뉴메코를 통해 보툴리눔 톡신 신제품 ‘뉴럭스’도 국내dp 출시했다. 회사는 뉴럭스 역시 향후 FDA 허가를 신청할 계획이며, 현재 호주에서 임상 2상을 마쳤다.
메디톡스 관계자는 “FDA 심사는 서류 보완 사항이 생기지 않는다면 1년 내 결과를 확인할 수 있다”라며 “미국과 캐나다 등 북미 시장부터 공략할 계획”이라고 말했다. 이어 “뉴럭스도 미국 허가 신청 계획이 있지만, 아직 구체적으로 추진 중인 절차는 없다”라고 덧붙였다.
대웅제약은 중국 진출에 박차를 가하고 있다. 2021년 중국 NMPA에 허가를 신청했으며, 올해 결과가 나올 것으로 예상된다. 업계에서는 대웅제약이 지난해 중국 허가를 받을 것으로 전망했지만, 소식 없이 해를 넘겼다.
생산시설도 확대한다. 대웅제약은 올해까지 총 1000억 원을 투입해 경기도 화성 향남에 나보타 3공장을 준공한다. 완공 시 대웅제약의 연간 보툴리눔 톡신 생산 역량은 1~2공장을 더해 최대 1800만 바이알로 늘어난다.
대웅제약 관계자는 “허가 심사는 모든 절차가 문제없이 진행되고 있다. 코로나19 팬데믹이 심사 지연에 영향을 미쳤을 가능성이 있다”면서 “3공장 완공 시 해외 진출로 증가할 물량을 감당할 수 있을 것으로 예상한다”라고 말했다.











![[컬처콕 플러스] '아파트' 대박난 로제, 제니·로사와 다른 점은?](https://img.etoday.co.kr/crop/320/200/2099568.jpg)